Komplexní zdroj informací určený pacientům, kterým byl předepsán přípravek IDACIO®▼ (adalimumab)
a jejich lékařům a zdravotníkům, jehož cílem je podpora pacientů v průběhu jejich onemocnění
Klikněte zde a zaregistrujte pro získání plného přístupu na webové stránky.
Tato registrace je určena pouze pro lékaře, kteří léčí pacienty lékem IDACIO®.
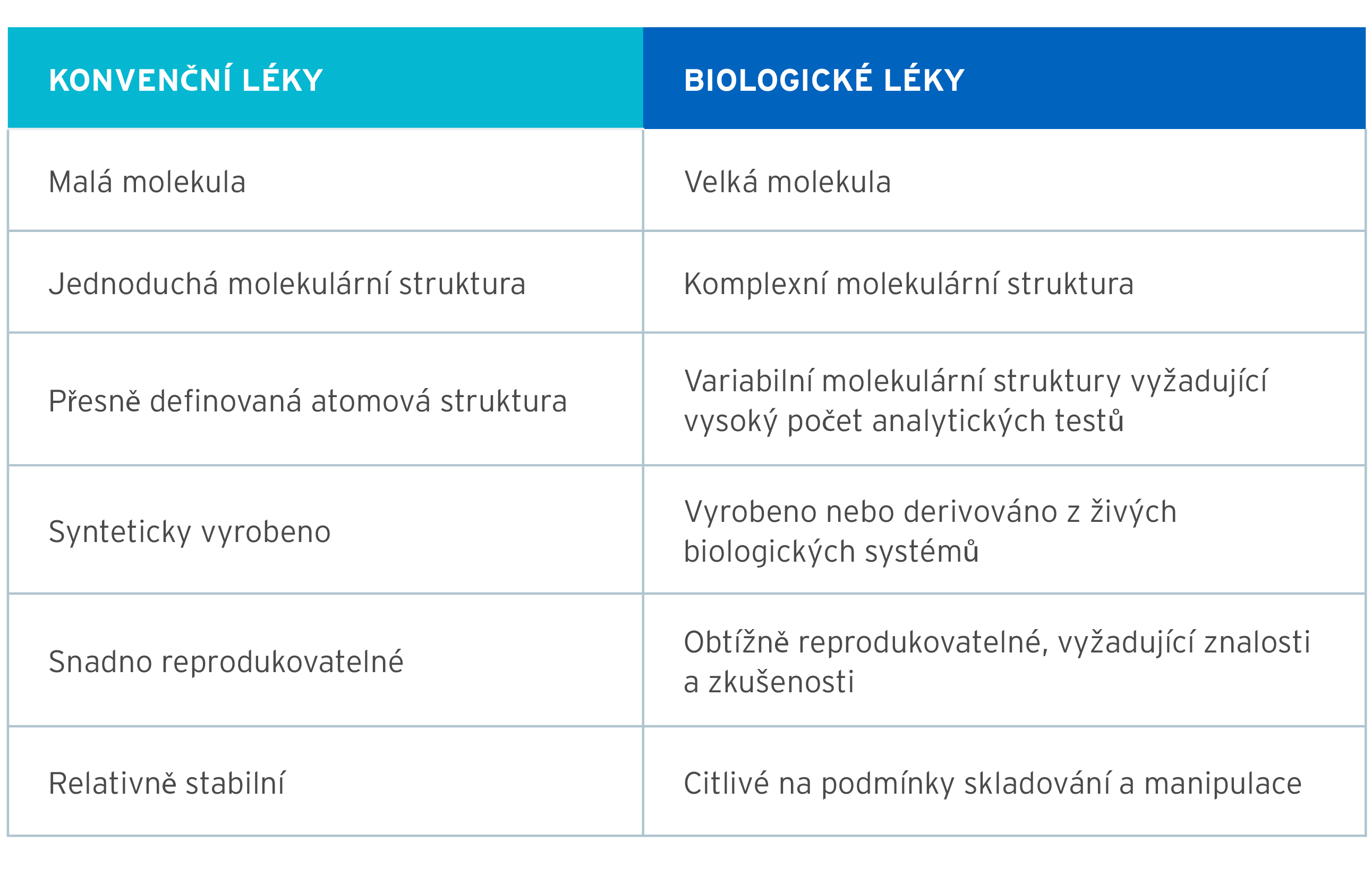
Biologické léky způsobily revoluci v léčbě mnoha chronických a život ohrožujících onemocnění.1 Biologické léky jsou definovány jako komplexní molekulární proteiny, které jsou vytvořeny nebo derivovány z živých biologických systémů, a které využívají nejmodernější rekombinantní biotechnologické postupy.1
Uvedená tabulka shrnuje rozdíly mezi konvenčními a biologickými léky (např. adalimumabem).1,2,3
Evropská léková agentura definuje biosimilární lék jako “lék velmi podobný jinému biologickému léku, který je schválen v EU (tzv.”Referenční lék”).” 4 Biosimilarní léky nejsou generické léky.4 Generický lék je identický nebo bioekvivalentní s referenčním lékem ve všech aspektech, protože je vytvářen chemickou syntézou.4 Biosimilární lék je velmi podobný, nikoliv totožný s referenčním lékem, protože je produkován v živých buňkách.4 V porovnání s referečním přípravkem však nesmí existovat žádné klinicky významné rozdíly, ohledně účinnosti nebo bezpečnosti.4
Po vypršení patentové ochrany mohou farmaceutické společnosti vyvíjet a uvádět biosimilarní léky na trh.4 Biosimilární léky, které prokázaly rovnocennou klinickou účinnost a podobný bezpečnostní profil jako referenční léky,4 jsou stále více využívány systémy zdravotní péče, protože nabízejí úsporu nákladů
a zvýšení dostupnosti nejmodernější terapie většímu počtu pacientů.4
Biosimilární léky procházejí přísnými testy, při kterých musí prokázat, že jsou podobné referenčnímu léku. Jedná se o tří typy studií:4
Srovnávací studie kvality: Tyto in vitro studie porovnávají strukturu proteinů a biologickou funkci mezi biosimilárním a referenčním lékem.
Srovnávací neklinické studie: zahrnují farmakodynamické studie (obvykle in vitro)
za účelem porovnání biosimilárního a referenčního léku. V některých případech jsou vyžadovány in-vivo
toxikologické studie.
Srovnávací klinické studie: Klinické studie jsou určeny k potvrzení biologické podobnosti
a zahrnují studie zaměřené na toxikologii, farmakokinetiku a famakodynamiku u zdravých dobrovolníků a účinnost alespoň v jedné indikaci, pro kterou je referenční lék schválen. Následují studie k prokázání podobné, bezpečnosti a imunogenicity.
Regulační pokyny pro schvalování biosimilárních léků umožňují extrapolaci indikací.4
To znamená, že všechny dostupné údaje o biosimilárním a referenčním léku v jedné indikaci mohou být použity k získání schválení pro použití biosimilárních léků v jiných indikacích referenčního léku.4
Bezpečnost je pro schválení nového biosimilárního léku rozhodující. Nesmí prokazovat žádné klinicky významné rozdíly v imunitní odpovědi ve srovnání s referenčním lékem. Imunitní reakce mohou ovlivnit jak bezpečnost, tak účinnost přípravku. V některých případech může být nutné provést zvláštní studie zaměřené na sledování imunogenicity.
Biosimilarní léky jsou schváleny jako vysoce podobné biologickému referenčnímu léku
s tím, že mezi nimi nesmí být klinicky významné rozdíly. V důsledku toho může být pacient pod vedením lékaře a při pečlivém sledování převeden z referenčního léku na biosimilární lék. Přibývá klinických důkazů, že přechod z referenčního léku na biosimilární lék nemá vliv na účinnost a bezpečnost léčby.
Úplný obsah webových stránek získáte kliknutím sem. Ten je k dispozici pouze pro zdravotnické odborníky, kteří léčí pacienty přípravkem IDACIO®.
1. Abraham J. Developing oncology biosimilars: An essential approach for the future. Semin Oncol 2013;40(Suppl1):S5-S24
2. Kozlowski S, Woodcock J, Midthun K, Sherman RB. Developing the Nation’s Biosimilar Program. N Engl J Med 2011;365:385-388
3. European Generics Medicines Association (EGA) Biosimilar Medicines Handbook. 2016 [online]. Dostupné na: http://www.medicinesforeurope.... [Platné k datu únor 2019]
4. Biosimilars in the EU. Information guide for healthcare professionals. European Medicines Agency. Dostupné na: https://www.ema.europa.eu/docu... [Platné k datu únor 2019]
5. Cohen HP, Blauvelt A, Rifkin RM, Danese S, Gokhale SB, Woollett G. Switching reference medicines to biosimilars: A systematic literature review of clinical outcomes. Drugs. 2018 Mar;78(4):463-478.
Po registraci použijte níže uvedená pole pro přihlášení.
Nyní opouštíte webové stránky KabiCare. Rádi bychom vás upozornili, že nemáme žádnou spojitost ani kontrolu nad obsahem dostupným na externích webových stránkách třetích stran.
Pokračovat